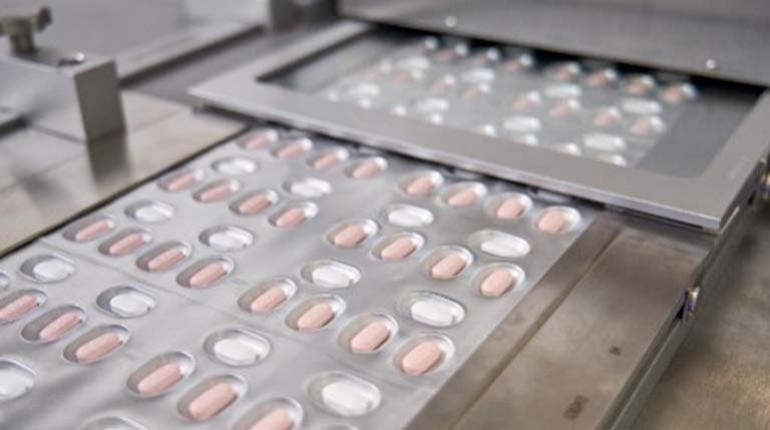
La primera p├¡ldora contra el Covid-19 de la l├¡nea Pfizer, fue autorizada por la Administraci├│n de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en ingl├®s).
La cient├¡fica de la FDA, Patrizia Cavazzoni, en un comunicado expres├│ su alegr├¡a por un ÔÇ£paso m├ísÔÇØ en la lucha contra la enfermedad.
“Esta aprobaci├│n proporciona una nueva herramienta para luchar contra el Covid-19 en un momento cr├¡tico de la pandemia, en el que est├ín surgiendo nuevas variantes”, manifest├│.
Tratamiento Paxlovid
El tratamiento de Pfizer, llamado Paxlovid, consiste en dos p├¡ldoras diarias durante cinco d├¡as. A diferencia de las vacunas, la p├¡ldora anticovid no se dirige a la prote├¡na de pico, en constante evoluci├│n del coronavirus, utilizada para invadir las c├®lulas.
Según la empresa, un ensayo clínico entre 2.200 personas demostró que el tratamiento es seguro y presuntamente reduce el riesgo de hospitalizaciones y muertes entre las personas en riesgo en un 88 por ciento.
La autorizaci├│n se produce en momentos en que los casos en Estados Unidos van en ascenso, debido a la variante ├│micron, report├│ la agencia internacional AFP.
Expertos independientes votaron a favor de ese tratamiento por un estrecho margen, pero expresaron preocupaciones en torno a su seguridad, como el da├▒o potencial a los fetos de mujeres embarazadas y a la cadena de ADN.
Venta con receta m├®dica
La pastilla solo podr├í ser comprada con receta m├®dica y los pacientes deben tomarla tan pronto como sepan que tienen la enfermedad, como m├íximo dentro de los cinco primeros d├¡as en que se presentaron los s├¡ntomas.
La píldora funciona bloqueando la actividad de una encima específica que el coronavirus necesita para replicarse en el cuerpo infectado.
Los datos m├ís recientes de Paxlovid aseguran que el medicamento es un “inhibidor potente” ante la variante ├│micron, de acuerdo al reporte del portal DW.
/JDLF/